C’est une question qui fait actuellement débat, bien que le sujet date des années 1980. Peut-on considérer les oméga 3 dangereux dans certains contextes ? Je n’aurai d’ailleurs pas de réponse catégorique. Tout dépend du contexte nutritionnel, des éléments étudiés, des acides gras analysés et de la méthodologie des études considérées.
Oméga 3 et prévention cardio-vasculaire, que disent les études récentes ?
Plusieurs méta-analyses montrent une absence d’effets significatifs d’une supplémentation en EPA/DHA sur le plan cardiovasculaire ou chez les diabétiques. Deux d’entre-elles, publiées dans la revue JAMA en 2012 1et 2018 2, le suggèrent. Toutefois, il est important de préciser que la plupart des études concernées considèrent des doses insuffisantes pour obtenir un indice oméga 3 membranaire synonyme de prévention cardiovasculaire, à savoir une quantité supérieure à 1800 mg par jour. Cet indice oméga 3 est pourtant un marqueur particulièrement intéressant et défini depuis plus de dix ans 3. Or il n’est généralement pas dosé dans ces études, il s’agit pourtant d’un point essentiel pour déterminer l’efficacité d’une supplémentation. En effet, selon l’état nutritionnel en oméga 3 de la personne, les effets de la supplémentation peuvent apparaître très différents. A titre d’exemple, le risque de maladies cardio-vasculaires est réduit de 30 % lorsque cet indice évolue de 4 à 8 % selon une étude récente 4. Par ailleurs, la prévention dans ces méta-analyses était considérée comme non significative par les auteurs bien qu’elle s’avérait améliorée de 7 %. La plupart des études épidémiologiques (NDLR : ayant un poids plus important que les études cliniques menées) montrent, elles, une corrélation positive entre le statut membranaire en EPA/DHA et la prévention des maladies coronariennes. Une autre méta-analyse parue dans JAMA confirmait l’intérêt de consommer du poisson gras 1 à 2 fois par semaine dans le cadre de la prévention cardio-vasculaire, y compris en considérant les contaminants 5. La méta-analyse publiée en 2012 dans JAMA a étudié les effets cardioprotecteurs d’une supplémentation en oméga 3 en prévention secondaire, c’est à dire chez les personnes ayant déjà eu une pathologie. Ces résultats ne peuvent donc pas être extrapolés à la population générale. Par ailleurs, les doses utilisées en référence étaient de 1000 mg pendant 1 an, soit un dosage et une durée pouvant être considérés comme insuffisants en cas de prévention secondaire. A l’inverse, une revue de littérature de 2009, incluant plus de 39 000 patients ayant souffert d’accident cardio-vasculaire et soumis à une supplémentation moyenne de 1800 mg pendant plus de 2 ans, a démontré quant à elle un effet protecteur des oméga 3 6. D’une manière générale, les études ou méta-analyses récentes mettant en évidence l’effet protecteur des oméga 3 en cas de supplémentation à dose suffisante (plus de 1800 mg par jour) sont nombreuses et bien menées 7.
Les compléments alimentaires en EPA et DHA sont-ils dangereux ?
Dans ce contexte plutôt positif des effets des oméga 3 sur la prévention cardio-vasculaire, se pose légitimement la question de l’intérêt de la supplémentation. Certaines études datant des années 80 montrent une augmentation de la mortalité cardiovasculaire à la suite d’une supplémentation en EPA/DHA sur le long terme. Ces résultats ont toutefois été peu confortés et il s’agit avant tout d’études d’observation et non d’intervention. Plusieurs sont en en cours, intégrant de vastes cohortes. Elles devraient apportées une tendance plus précise (notamment en cas de dosages > 4 g/j). Nous parlons bien ici du cas de l’EPA et/ou du DHA et non de l’ALA, car concernant ce dernier, il n’y a aucun élément remettant en question son intérêt.
Les effets délétères mis en avant sont multiples, notamment un risque majoré de péroxydation lipidique 8,9,10 et une production accrue d’acroléïne, de lipofuscine, de céroïdes, des pigments impliqués dans le vieillissement cellulaire11 et les maladies neurodégénératives12, notamment par manque de vitamine E. En effet, au regard du nombre de doubles liaisons des acides gras poly-insaturés, leur sensibilité à l’oxydation est très importante. Il a été démontré qu’une supplémentation « mobilise » si fortement la vitamine E que cette dernière ne suffit pas à éviter cette peroxydation, y compris lorsque l’on en rajoute dans le complément alimentaire à forte dose (l’effet peut alors être pire, sauf en cas d’utilisation d’extrait de romarin13,14 ou lorsque la supplémentation en EPA/DHA demeure faible). Par ailleurs, le taux d’EPA ou de DHA non oxydé chute alors fortement15.
Plusieurs études ont mis en évidence d’autres effets délétères d’une supplémentation en EPA et DHA sous forme d’huile de poisson, notamment une augmentation des risques d’immunosuppression16-19, d’Alzheimer20, une atteinte du fonctionnement mitochondrial21 et neuronal (notamment par excès d’acroléïne), un dysfonctionnement thyroïdien ou encore une augmentation de l’incidence du cancer (notamment de la prostate). C’est là encore une question de bon-sens lorsque l’on connait la modulation de l’EPA sur le métabolisme des prostaglandines, des leucotriènes et des thromboxanes. Par ailleurs, l’EPA et le DHA possèdent des effets pro-oxydatifs évidents lorsque l’oxydation est initiée, majorant de fait les troubles évoqués. C’est donc bien là toute la question : comment réussir à apporter des oméga 3 intègres sans augmenter les risques oxydatifs par lipopéroxydation. Sur ce point, force est de constater qu’au regard des qualités proposées, les compléments alimentaires n’apparaissent pas comme une solution optimale.
Tous ces arguments demeurent recevables, mais ils méritent d’être nuancés. En premier lieu, le statut antioxydant général, donc la qualité de l’alimentation quotidienne, est essentiel. Si la supplémentation est proposée sur un terrain oxydatif (à fortiori si le complément est de mauvaise qualité) et/ou si l’alimentation est pauvre en antioxydants, elle ne peut qu’accentuer les risques de péroxydation. Ce point recentre le débat de fond sur le véritable sujet : l’importance d’optimiser le statut nutritionnel par les aliments, intégrant les nutriments dans une matrice alimentaire, avant toute démarche de supplémentation. Ce statut n’est pourtant généralement pas pris en compte par les études critiquant (dans un sens ou un autre) l’intérêt des oméga 3. Il s’agit pourtant d’un point essentiel source de raccourcis caricaturaux trompeurs dans l’esprit d’un grand nombre, notamment des médias. Les études épidémiologiques ne remettent pas en question l’importance des oméga 3 sous forme alimentaire dans la prévention cardio-vasculaire. Les niveaux d’oxydation apparaissent délétères uniquement dans le cadre d’une consommation de compléments alimentaires et non d’aliments cuits de manière douce. Prenons quelques exemples.
Comment mesure-t-on la péroxydation des oméga 3 ?
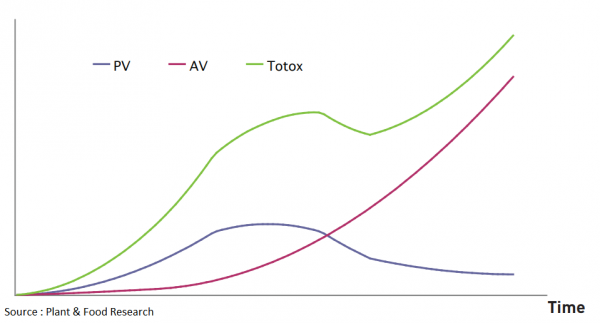
Lorsqu’une graisse s’oxyde, plusieurs composés sont produits, certains sont qualifiés de primaires et d’autres de secondaires. Les premiers sont mesurés à travers l’indice de peroxyde (PV, devant être inférieur à 5 meq/kg), les seconds grâce à l’indice d’anisidine (AV devant être inférieur à 20 meq/kg) et l’indice général est qualifié de TOTOX (il correspond à l’addition du double de l’indice de peroxyde et de l’indice d’anisidine, il doit être inférieur à 26 meq/kg).
Cinétique d’oxydation des lipides
Dans le cas du saumon en conserve, le PV moyen est de 2,6 et l’AV de 4,322).
Concernant la sardine en conserve (de métal), le produit demeure stable au cours du temps mais le niveau de péroxydation initiale (PV) apparaît au-dessus de la valeur cible de 5 mg/kg23.
Le maquereau surgelé atteint quant à lui le seuil supérieur de tolérance de péroxydation après un à deux mois de surgélation (-18°C)24, justifiant encore une fois d’éviter de conserver les poissons gras au congélateur pendant de nombreux mois.
La méthode de fumage ne protège pas de la péroxydation elle non plus mais elle ne dépasse pas le seuil considéré comme critique25. Ce résultat est toutefois à nuancer par le fait que le fumage génère des hydrocarbures cancérigènes26.
La cuisson à la vapeur demeure la meilleure solution pour limiter cette péroxydation (dans le cas du saumon, le TOTOX est de 4,4) 27.
Par ailleurs, le mode de préparation semble jouer : étonnement, le fait de hacher la viande permet de réduire l’oxydation par l’action protectrice des autres nutriments, notamment les protéines28.
Bien entendu, l’état de fraîcheur initiale du poisson intervient.
Enfin, l’utilisation d’une marinade à base de végétaux (ou l’adoption d’une alimentation riche en fruits et légumes) semble le meilleur moyen d’éviter cette oxydation, notamment grâce à la présence de composés phénoliques29,30.
Notons que les oméga 3 présents dans les œufs semblent mieux protégés de la péroxydation grâce à la matrice alimentaire31, y compris lorsque l’alimentation des poules est riche en oméga 332. La présence de fer (hème) dans les aliments augmente le risque de péroxydation, comme dans le maquereau par exemple.
Compléments alimentaires : que disent les analyses sur les risques d’oxydation ?
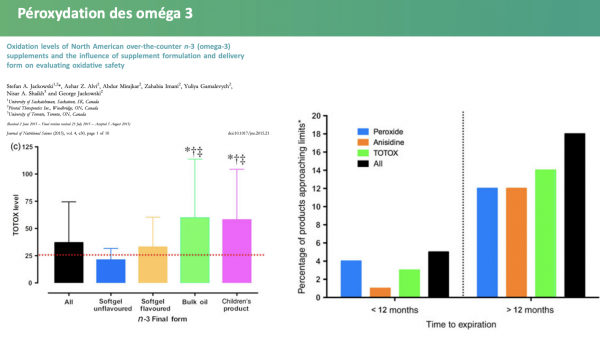
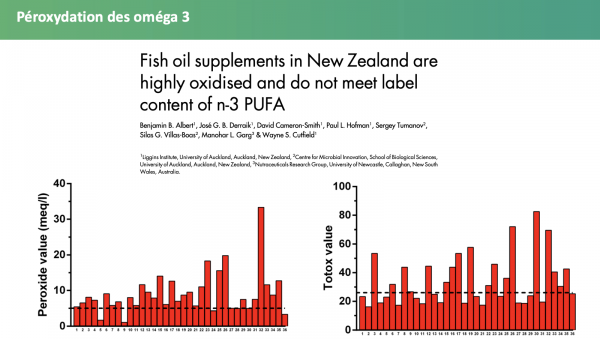
De nombreuses études délivrent un constat sans appel, les compléments alimentaires sont bel et bien oxydés33-41, autant en Europe qu’en Amérique du nord :
- Le seuil limite d’indice de peroxyde est dépassé dans la plupart des compléments alimentaires, jusqu’à 93 % dans certains cas. Les seuils de dépassement peuvent atteindre jusqu’à 6 fois la limite maximale et les supplémentations pour enfants apparaissent encore plus touchées42. Ces chiffres sont d’autant plus inquiétants que les tests étaient généralement réalisés bien avant l’atteinte de la date limite de durabilité (DDM)… ce qui sous-entend que le niveau d’oxydation serait bien plus élevé (pour information 22 jours de conservation augmente l’indice de peroxyde de 20 %43). Il ne s’agit pas pour autant d’incriminer les industriels à l’origine de la vente de ces produits, toutefois une réglementation plus stricte destinée à encadrer le niveau de péroxydation mériterait d’être instaurée, notamment en réduisant la date de durabilité minimale ;
- Il serait nécessaire de chauffer les huiles au-delà de 225°C pendant 25 minutes pour atteindre des seuils d’oxydation équivalents à ceux des compléments alimentaires…44.
Faut-il déconseiller totalement les oméga 3 ?
Certains auteurs vont jusqu’à reconsidérer le caractère essentiel des acides gras poly-insaturés. Là aussi, et c’est ce que montrent de nombreuses études concernées, la fonctionnalité de la delta-6-désaturase et le statut en cofacteurs (en particulier en Mg et en vit. B6) déterminent fortement la capacité de l’organisme à fabriquer ses propres acides gras poly-insaturés à partir d’acides gras à chaîne plus courte. Un statut important en acide arachidonique (ce qui est le cas chez la plupart de la population occidentale) vient également moduler le besoin en EPA. En effet, plus les apports en acide arachidonique seront importants, plus ceux en EPA devront l’être également pour maintenir une balance équilibrée. Il est vrai que dans un contexte où le statut nutritionnel serait optimal et l’enzyme fonctionnelle (soit entre 2 et 10 % de la population (voir mon article Pourquoi manger bien gras sur le sujet) la question de la réduction des apports en acides gras poly-insaturés alimentaires apparaîtrait légitime, notamment dans l’objectif de limiter la péroxydation. Or ce n’est pas le cas de la majorité de la population, consommant par ailleurs peu d’antioxydants. Ainsi, dans un cas comme dans l’autre, la situation apparaît délétère.
Je reviens toujours au même point – déterminant – à savoir l’importance de maintenir l’homéostasie en évitant tout excès, dans un sens ou un autre (à savoir ici la supplémentation à long terme et à fort dosage). A noter par ailleurs que l’agence européenne de contrôle réglementaire (EFSA) confirme l’absence de risques de saignements jusqu’à 5 g/j45.
En conclusion
Ces éléments ne remettent à mon sens pas en question l’intérêt d’une supplémentation ponctuelle en cas de déficit identifié, notamment par manque d’apports alimentaires. Si vous y avez recours, je vous recommande :
- De demander au fabricant les résultats d’analyse de péroxydation ;
- D’acheter ceux qui sont produits le plus récemment possible ;
- De les conserver au congélateur (oui, oui !) ;
- D’éviter les formes en flacons (au profit des capsules) et/ou aromatisées tout en privilégiant la protection par des extraits végétaux (par exemple romarin).
Une façon très empirique d’évaluer le niveau d’oxydation potentielle peut être de percer une capsule pour la sentir et vérifier qu’elle ne sent pas… le poisson avarié (quand elle n’est pas aromatisée bien sûr). Un tel geste ne garantira pas la faible oxydation de l’huile mais si elle sent mauvais, vous saurez alors qu’il faut la jeter…
Quant à la supplémentation chronique en EPA et DHA à fortes doses, elle peut être discutée, notamment en cas de recours à un complément alimentaire de mauvaise qualité, mais elle ne remet nullement en question l’importance du statut membranaire en EPA/DHA. Or ce statut est dépendant de la prédisposition individuelle, de la fonctionnalité de la delta 6 désaturase, de l’apport conjoint d’acide arachidonique, donc de l’alimentation, y compris des apports glucidiques. C’est pourquoi réaliser un profil en acides gras membranaires doit permettre d’orienter la prise de décision quant à l’intérêt d’une supplémentation en EPA/DHA, notamment dans le cadre d’une indication cardiovasculaire, en accompagnement de cancer, de troubles immunitaires, inflammatoires ou de la thyroïde. Un bilan de stress oxydatif peut également préciser le « terrain » et donc les risques de péroxydation. Certains vont jusqu’à remettre en question l’intérêt général des oméga 3 à longue chaîne, ce n’est à ce jour pas ma position, encore moins concernant la forme végétale alimentaire (acide alpha-linolénique ou ALA). Cette dernière a en effet bien démontré son effet protecteur et sa moindre sensibilité oxydative, notamment dans le cadre d’une alimentation de type méditerranéen 4. Pour autant, à peine 1 % de la population française en consomme suffisamment 46. Le reste nous amène dans des réflexions physiologiques, biochimiques, conceptuelles (et commerciales ?) que nous ne maîtrisons pas, tant tout est interdépendant. Nous tombons alors, via ces conclusions d’études, dans les mêmes travers que le raisonnement allopathique. Conservons notre humilité.
Anthony Berthou
Sources :
(1) Rizos EC, Ntzani EE, Bika E, Kostapanos MS, Elisaf MS. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis. JAMA. 2012;308(10):1024-1033. doi:10.1001/2012.jama.11374
(2) Aung T, Halsey J, Kromhout D, Gerstein HC, Marchioli R, Tavazzi L, et al. Associations of Omega-3 Fatty Acid Supplement Use With Cardiovascular Disease Risks: Meta-analysis of 10 Trials Involving 77 917 Individuals. JAMA Cardiol. 31 janv 2018.
(3) Von Schacky C, Harris WS. Cardiovascular risk and the omega-3 index. J Cardiovasc Med (Hagerstown). 2007 Sep;8 Suppl 1:S46-9.
(4) Harris WS, Del Gobbo L, Tintle NL. The Omega-3 Index and relative risk for coronary heart disease mortality: Estimation from 10 cohort studies. Atherosclerosis. 2017 Jul;262:51-54.
(5) Mozaffarian D, Rimm EB. Fish intake, contaminants, and human health: evaluating the risks and the benefits. JAMA. 18 oct 2006;296(15):1885(99).
(6) Marik PE, Varon J. Omega-3 dietary supplements and the risk of cardiovascular events: a systematic review. Clin Cardiol. 2009 Jul;32(7):365-72.
(7) Alexander DD, Miller PE, Van Elswyk ME, Kuratko CN, Bylsma LC. A Meta-Analysis of Randomized Controlled Trials and Prospective Cohort Studies of Eicosapentaenoic and Docosahexaenoic Long-Chain Omega-3 Fatty Acids and Coronary Heart Disease Risk. Mayo Clin Proc. 2017 Jan;92(1):15-29. / Marik PE, Varon J. Omega-3 dietary supplements and the risk of cardiovascular events: a systematic review. Clin Cardiol. 2009 Jul;32(7):365-72. doi: 10.1002/clc.20604. / Tenenbaum A, Fisman EZ. Omega-3 polyunsaturated fatty acids supplementation in patients with diabetes and cardiovascular disease risk: does dose really matter ? Cardiovasc Diabetol. 2018 Aug 28;17(1):119. doi: 10.1186/s12933-018-0766-0.
(8) Chan PH, Fishman RA. Altérations de l’intégrité de la membrane et des constituants cellulaires par l’acide arachidonique dans les cellules de neuroblastome et de gliome. Cerveau Res. 1982, 23 septembre 248 (1): 151-7.
(9) Bate C, Reid S, Williams A . Les inhibiteurs de la phospholipase A2 ou les antagonistes du facteur d’activation plaquettaire empêchent la réplication du prion. J Neurosci Res. 2001 15 septembre; 65 (6): 565-72.
(10) Biochem Cell Biol. 1990 Apr;68(4):810-3. Cortisol catabolism by lymphocytes of patients with chronic lymphocytic leukemia. Klein A, Lishner M, Bruser B, Curtis JE, Amato DJ, Malkin A.
(11) Richter T, Munch G, Luth HJ, Arendt T, R Kientsch-Engel, Stahl P, Fengler D, Kuhla B. Réactivité immunochimique d’anticorps spécifiques de “produits de glycation avancée” avec des “produits de lipoxydation avancés”. Neurobiol vieillissement. 2005 avril; 26 (4): 465-74.
(12) Lovell MA, Xie C, Markesbery WR. L’acroléine, produit de la peroxydation des lipides, inhibe l’absorption du glucose et du glutamate dans les cultures neuronales primaires. Biol Med. 2000 15 octobre; 29 (8): 714-20.
(13) Sydenham E, Dangour AD, Lim W-S. Omega 3 fatty acid for the prevention of cognitive decline and dementia. Cochrane Database Syst Rev. 13 juin 2012;(6):CD005379.
(14) O’Sullivan A, Mayr A, Shaw NB, Murphy SC, Kerry JP. Use of Natural Antioxidants to Stabilize Fish Oil Systems. J Aquat Food Prod Technol. 13 oct 2005;14(3):75-94.
(15) Cillard J, Cillard P. Mécanismes de la peroxydation lipidique et des anti-oxydations. Ol Corps Gras Lipides. 1 janv 2006;13(1):24-9.
(16) Switzer KC, McMurray DN, Morris JS, Chapkin RS. (n-3) Polyunsaturated fatty acids promote activation-induced cell death in murine T lymphocytes. J Nutr. 2003 Feb;133(2):496-503.
(17) Klein A, Bruser B, Robinson JB, Pinkerton PH, Malkin A.Effect of a non-viral fraction of acquired immunodeficiency syndrome plasma on the vulnerability of lymphocytes to cortisol. J Endocrinol. 1987 Feb;112(2):259-64.
(18) Klein A, Bruser B, Malkin A. The effect of fatty acids on the vulnerability of lymphocytes to cortisol. Klein A, Bruser B, Malkin A. Metabolism. 1989 Mar;38(3):278-81.
(19) Tumour Biol. 1989;10(3):149-52. Albumin and the unique pattern of inhibitors of cortisol catabolism by lymphocytes in serum of cancer patients.
(20) Lovell MA, Xie C, Markesbery WR. Acrolein, a product of lipid peroxidation, inhibits glucose and glutamate uptake in primary neuronal cultures. Free Radic Biol Med. 2000 Oct 15;29(8):714-20.
(21) Hillered L, Chan PH. Role of arachidonic acid and other free fatty acids in mitochondrial dysfunction in brain ischemia. J Neurosci Res 1988 Aug;20(4):451-6.
(22) Ortiz J, Vivanco JP, Aubourg SP. Lipid and sensory quality of canned Atlantic salmon (Salmo salar): Effect of the use of different seaweed extracts as covering liquids. Eur J Lipid Sci Technol. 1 mai 2014;116(5):596-605).
(23) Selmi S, Monser L, Sadok S. Influence of local canning process and storage on pelagic fish from Tunisia: fatty acid profiles and quality indicators. J Food Process Preserv. 2008.
(24) Nazemroaya S, Sahari MA, Rezaei M. Effect of frozen storage on fatty acid composition and changes in lipid content of Scomberomorus commersoni and Carcharhinus dussumieri. J Appl Ichthyol Z Für Angew Ichthyol. 2009.
(25) Kolodziejska I. , Niecikowska C. , Sikorski Z.E. , Kolakowska A. Lipid oxidation and lysine availability in Atlantic mackerel hot smoked in mild conditions. Bulletin of the Sea Fisheries Institute. 2004;(1).
(26) Stoyhwo A, Sikorski ZE. Polycyclic aromatic hydrocarbons in smoked fish – a critical review. Food Chem. 1 juin 2005;91(2):303-11.
(28) Domiszewski Z. Effect of heating fatty fish: Baltic herring (Clupea harengus membras), European sprat (Sprattus sprattus) and rainbow trout (Oncorhynchus mykiss) on lipid oxidation and contents of eicosapentaenoic and docosahexaenoic acids. Int J Food Sci Technol. 1 avr 2013;48(4):786-93.