Le fer représente un des minéraux dont la gestion nutritionnelle est particulièrement complexe. Si vous en manquez, vous voilà exposé(e) aux risques de fatigue, d’infections voire d’infertilité. En excès il devient un des éléments les plus pro-oxydatifs. Tout est encore une fois une question d’équilibre.
Malgré sa présence en faible quantité dans l’organisme, le fer est indispensable pour préserver la santé et la vitalité. Il permet notamment à l’oxygène d’être transporté par les globules rouges dans le sang grâce à l’hémoglobine, expliquant ainsi qu’une anémie (faible taux de globules rouges dans le sang) soit à l’origine d’une fatigue physique intense (par manque d’oxygénation des organes). Il est d’ailleurs abondant dans les muscles pour assurer leur bon fonctionnement en étant associé à la myoglobine. Les globules blancs en stockent également.
Les besoins moyens en fer sont d’environ 1,5 à 3 mg par jour pour l’homme, jusqu’à 5 mg pour la femme non ménopausée (les pertes peuvent varier selon l’importance des règles). Il s’agit d’un minéral particulièrement mal assimilé, de l’ordre de 10% en moyenne. Le fer d’origine animale (hormis l’œuf), dit héminique, est assimilé à hauteur d’environ 20 à 25% contre 5 à 10% pour la forme d’origine végétale dite non-héminique. Les besoins alimentaires sont donc estimés entre 10 et 30 mg par jour. Or, l’alimentation apporte en moyenne 6 mg de fer par tranche de 1000 kcal, exposant ainsi les femmes non ménopausées à un risque important de déficit, voire de carence.
Manquez-vous de fer ?
- Une pratique sportive intensive, par :
- Augmentation transitoire de la synthèse de globules rouges,
- Rupture des membranes cellulaires des globules rouges (hémolyse mécanique),
- Hémorragies digestives et rénales,
- La sudation : une transpiration de 2 à 3 L de sueur peut expliquer une perte d’environ 1 mg de fer par jour.
- Des pertes menstruelles importantes chez la femme non ménopausée1.
- La grossesse.
- Des hémorragies insidieuses (ulcérations digestives) ou extériorisées (métrorragies, hématomes).
- Une perturbation du microbiote intestinal2: une infection à salmonelle (Salmonella enterica), augmente la production d’un peptide, « la lipocaline-2 », interférant avec l’absorption du fer par les bactéries intestinales3.
Lorsque l’on évoque une carence en fer, le terme souvent utilisé est l’anémie. Or cette dernière caractérise avant tout un manque d’hémoglobine et non obligatoirement de fer (anémie dite ferriprive). Il existe en effet d’autres facteurs à l’origine d’une anémie : une hypothryoïdie, un déficit en vitamines B9 ou B12 (augmentation du volume globulaire moyen VGM, on parle alors d’anémie de Biermer ou mégaloblastique4) ou encore une inflammation (dans ce dernier cas, le taux de ferritine est plus élevé).
Identifiez votre déficit
Votre indice Fer vous apporte une analyse fine de vos apports alimentaires et des signes mettant en évidence un déficit potentiel. Toutefois, avant toute démarche de supplémentation, je vous conseille de vérifier votre statut en Fer par une analyse de sang.
Quels sont les signes d’un déficit en fer ?
La carence en fer se traduit avant tout par une fatigue générale du fait de la moindre capacité à transporter l’oxygène. D’autres signes non spécifiques peuvent être associés :
- Baisse de la force physique, voire intolérance à l’effort,
- Perte de cheveux, pâleur, ongles cassants, glossite,
- Maux de tête,
- Infections à répétition ou faible immunitaire,
- Baisse de l’attention, troubles de la mémoire,
- Syndrome des jambes sans repos,
- Dyspnée (difficultés à respirer),
- Perturbation ou arrêt des règles chez la femme non ménopausée,
- Syndrome de Pica : trouble du comportement alimentaire se traduisant par la consommation non contrôlée de substances non alimentaires telles que la terre, la cendre, la poussière, la craie, les plastiques, le papier, etc.
Plusieurs marqueurs peuvent être utilisés pour identifier un déficit en fer :
- La transferrine. Il s’agit de la forme de transport du fer dans le sang. Elle ne représente donc pas un reflet pertinent des réserves en fer.
- La ferritine est souvent utilisée (norme entre 50 et 200 µg/l) pour évaluer le statut en fer à travers une prise de sang. En effet, le fer est toxique pour l’organisme quand il est présent à l’état libre et, n’étant pas soluble, il doit être transporté par une protéine, la ferritine. Il s’agit toutefois d’un marqueur dont la valeur peut augmenter en cas d’inflammation (donc pas suffisamment spécifique pour diagnostiquer une anémie) ou d’atteinte hépatique lorsque les transaminases sont élevées.
- Coefficient de saturation de la transferrine : il s’agit du rapport entre le taux de fer sérique et la capacité totale de saturation de la transferrine (entre 15 et 35% pour une femme et 20 et 40% pour un homme).
- Le récepteur soluble à la transferrine représente un marqueur plus précis (normes de 2,2 à 5 mg/l pour les hommes et 1,9 à 4,4 mg/l pour les femmes). Des valeurs basses, entre 30 et 40 µg/l notamment, sont souvent considérées comme suffisantes dans certaines interprétations de bilan biologique.
- Au regard du temps nécessaire pour reconstituer les réserves (doubler une ferritinémie en 6 mois est déjà très bien), je vous conseille de réagir dès lors que la ferritinémie est inférieure à 40 µg/l et en vous référant au conseil préalable de votre médecin formé à la micronutrition.
L’excès est l’ennemi du bien
Le fer favorise le stress oxydant et peut donc être délétère lorsqu’il est présent dans l’organisme en excès, ce qui justifie une prudence particulière en cas de prise de compléments alimentaires. En effet, une quantité importante de fer apporté sous forme de supplémentation sature la transferrine. Il en résulte une présence de fer à l’état libre dans le sang à l’origine d’un stress oxydatif majeur via la réaction dite de Fenton. Cette réaction entraîne une augmentation du vieillissement cellulaire, des risques cardio-vasculaires ou de diabète 14,15 mais aussi de cirrhose, d’arthrose, de polyarthrite rhumatoïde, de maladie de Parkinson ou d’Alzheimer ou de prolifération microbiennes (les agents pathogènes se développent également grâce au fer).
L’hémochromatose est une maladie génétique à l’origine d’une accumulation importante de fer dans l’organisme (dans le foie en particulier). En dehors de cette pathologie, un excès chronique de fer (ferritine > 200 µg/l et/ou coefficient de saturation de la transferrine > 35 %) peut être à l’origine d’une atteinte des cellules du foie et du cœur notamment, une augmentation des risques d’arthrose et de polyarthrite rhumatoïde, une atteinte neuronale ou encore une prolifération bactérienne.
Excès de Fer et réaction de Fenton
Privilégiez les aliments riches en Fer bien assimilé
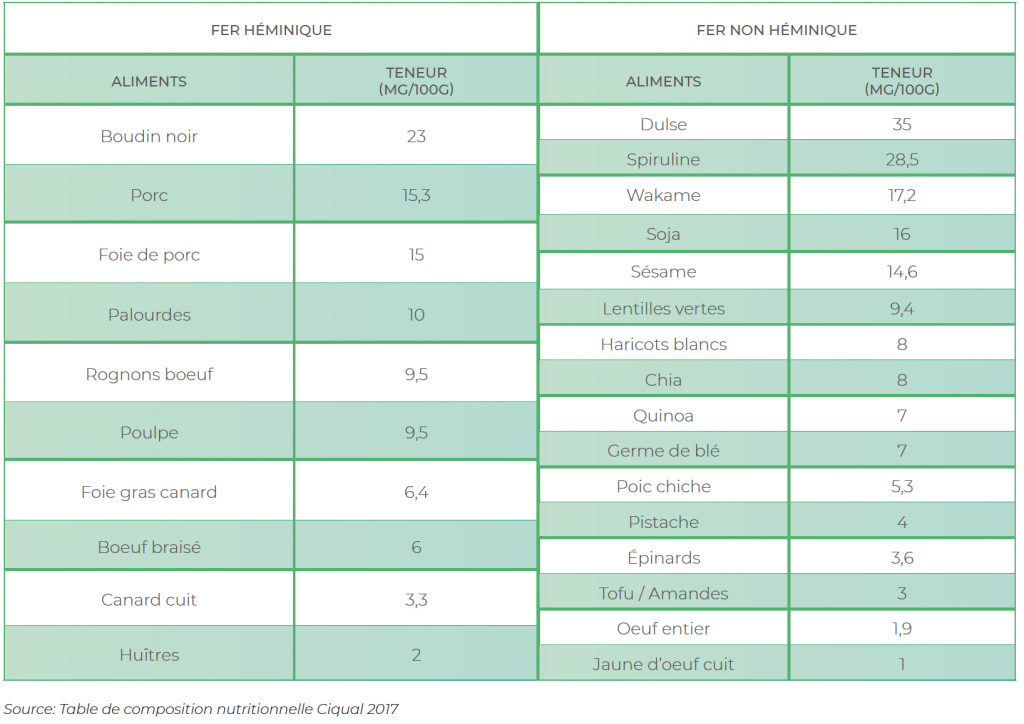
Les produits animaux demeurent les sources les plus intéressantes de fer dans la mesure où non seulement ils en sont riches, mais la forme présente dans l’aliment est trois à quatre fois mieux assimilée que celle issue des végétaux. On parle de fer héminique pour la forme présente dans le règne animal, et non-héminique pour les formes végétales (les œufs contiennent également cette forme). Le boudin noir est une source de référence en fer et peut être conseillé une fois par semaine en cas de déficit, si vous l’aimez bien entendu (le cuire le moins possible).
La consommation de vitamine C issue des végétaux permet d’améliorer grandement le taux d’assimilation du fer végétal. L’ajout de vitamine C synthétique (acide ascorbique) ne présente, elle, pas du tout les mêmes effets et s’avère donc inutile, voire délétère. C’est pourquoi je vous conseille de consommer des végétaux riches en vitamine C (kiwi, cassis, papaye, goyave, fruits rouges, agrumes, poivron, fenouil, choux, épinards) les plus frais possible et crus (sauf intolérance digestive), en particulier au cours des repas contenant des aliments riches en fer.
La viande rouge est souvent considérée comme l’aliment de référence pour apporter du fer. Toutefois la volaille et le poisson en contiennent également, en moindre quantité certes, mais de manière suffisante pour contribuer à satisfaire les besoins. Le besoin absolu de “viande rouge” fait donc partie de l’imaginaire. Bien au contraire, si votre statut en fer est satisfaisant, un apport excessif peut favoriser le développement de l’inflammation dite de bas-grade. Dans tous les cas, consommer une grande quantité de fruits et légumes afin de limiter le stress oxydatif associé au fer, d’apporter de la vitamine C et de réduire le pH intestinal favorisant l’assimilation du fer14.
Les algues représentent également des sources significatives de fer. Il est présent sous une forme non-héminique, mais entouré (ce que l’on appelle complexé) par de nombreuses molécules végétales lui permettant d’être très bien assimilé. La spiruline est souvent évoquée comme une source importante de fer. Elle en contient effectivement, mais en faible quantité rapportée de spiruline consommée. Il existe toutefois sur le marché de la spiruline enrichie en fer et présentant des concentrations environ sept fois plus importantes que les spirulines classiques. D’autres algues (Dulse, Wakame) en sont riches également.
Principales sources alimentaires de Fer
Tous droits réservés – Anthony Berthou – lanutritionpositive.com
Méfiez-vous de certains aliments
Certains aliments contiennent des substances pouvant réduire, voire bloquer l’assimilation de minéraux comme le Fer. Il s’agit notamment de :
- L’acide phytique présente dans les céréales complètes (blé et riz complet notamment) et les légumineuses (fèves et lentilles notamment)
- L’acide oxalique présent dans les épinards cuits, les betteraves, les bettes, la rhubarbe et le cacao notamment
- La présence de grandes quantités d’autres minéraux (magnésium et calcium, y compris dans les eaux fortement minéralisées) ou d’autres aliments (soja, produits laitiers, oeufs)
- Les additifs à base de phosphates que l’on retrouve communément dans la viande, les saucisses ou encore le fromage
Il n’en reste pas moins que les légumineuses (les lentilles notamment) représentent des sources intéressantes de Fer, d’autant plus lorsqu’elles sont associées à des aliments riches en vitamine C. D’une manière générale, une alimentation riche en végétaux apparaît favorable à la satisfaction des besoins en Fer au regard de l’ensemble de ces facteurs. Des personnes végétaliennes ou vegans, sensibilisées à l’importance de la nutrition, peuvent donc tout à fait présenter un statut nutritionnel en Fer adapté. Le trempage des légumineuses, voire la germination ainsi que la cuisson suffisante de ces aliments permettent de limiter l’action de ces phytates. De même, la consommation d’un pain au levain à fermentation longue en réduit les effets, à la différence de la levure et de la fermentation courte (voir les conseils généraux de votre programme à ce sujet). En effet, maintenir une consommation de céréales complètes et de légumineuses contribue à couvrir vos besoins quotidiens en fibres, notamment insolubles.
Les tanins présents dans le thé, mais aussi dans le vin rouge, le cacao ou encore le café altèrent l’assimilation du fer d’origine végétale. Il en est de même concernant les produits laitiers.
Afin de contrecarrer ces effets si vous êtes sujet(te) à un manque de fer, évitez de boire du thé au cours d’un repas riche en fer ou surtout en même temps qu’une supplémentation2,5. Il suffit d’en boire en dehors des repas (au minimum 20 min, certaines études précisant jusqu’à 1h)6. Les tanins sont extraits à haute température et lors d’une infusion longue. Consommer un thé vert infusé 2 à 3 min à 60°c limite ainsi l’effet chélateur sur le fer. S’il est vert et d’origine Sencha ou Shincha, il est par ailleurs riche en vitamine C dont on vient d’évoquer les intérêts. Pour autant, aucune étude contrôlée n’a permis d’identifier de manière claire que la consommation de thé au cours des repas par des personnes souffrant d’anémie puisse être à l’origine d’une augmentation de la carence6.
Optimisez votre statut nutritionnel en vitamine B12
La corrélation au statut en vitamine B12 est également importante afin d’écarter toute anémie liée à un déficit en cette vitamine (anémie dite de Biermer). En effet, la vitamine B12 joue un rôle essentiel dans la multiplication cellulaire, notamment des cellules à renouvellement rapide comme les globules rouges.
Prenez soin de votre intestin
De récentes études mettent en évidence que le microbiote intestinal possède un rôle régulateur vis-à-vis du métabolisme du fer. La muqueuse intestinale serait en mesure d’assimiler davantage de fer en cas de besoins accrus, et inversement de réduire son absorption en cas de présence importante. Une hormone dépendante du cuivre, l’hepcidine, serait également impliquée dans cette régulation7–9. A noter qu’une supplémentation en fer augmente de manière importante le taux plasmatique d’hépcidine10,11, qui diminue alors l’assimilation du minéral 12. Ceci démontre l’existence d’une autorégulation.
Des scientifiques de l’INRA et de l’INSERM, en collaboration avec le CNRS, se sont penchés sur la façon dont le microbiote affecte l’absorption intestinale du fer, indépendamment des effets hormonaux. Pour ce faire, ils ont comparé des animaux (rongeurs) dépourvus de microbiote intestinal (animaux dits “axéniques”) à ceux dont le microbiote était contrôlé. En l’absence d’un microbiote, les cellules intestinales présentaient de très faibles réserves de fer et les systèmes de transport vers le corps étaient très rares. En revanche, dès que le microbiote était présent dans l’intestin, ces cellules acquirent une capacité considérable de stockage du fer (sous forme de ferritine) favorisant son transport vers le corps (augmentation de la ferroportine). Ainsi, en présence de bactéries intestinales, les cellules intestinales ont adapté leur capacité à distribuer et à stocker le fer13.
Les sportifs réguliers peuvent présenter une perturbation de l’écosystème intestinal. Ceci vient s’ajouter aux facteurs de risque préexistant de déficit en Fer. Je vous invite donc à vous référer à l’article sur le pilier intestinal. Ainsi que celui sur la supplémentation Fer : quel complément alimentaire choisir ?
Anthony Berthou
Sources :
- Miller EM. Iron Status and Reproduction in US Women: National Health and Nutrition Examination Survey, 1999-2006. PLoS One. 2014;9(11). doi:10.1371/journal.pone.0112216
- Hibberd MC, Wu M, Rodionov DA, et al. The effects of micronutrient deficiencies on bacterial species from the human gut microbiota. Science Translational Medicine. 2017;9(390):eaal4069. doi:10.1126/scitranslmed.aal4069
- Ohland CL, Jobin C. Microbial Activities and Intestinal Homeostasis: A Delicate Balance Between Health and Disease. Cellular and Molecular Gastroenterology and Hepatology. 2015;1(1):28-40. doi:10.1016/j.jcmgh.2014.11.004
- Thereza-Filho MA, Bansho ETO, Tonon D, et al. Recurrent anaemia in a patient with lymphocytic gastritis and vitamin B12 deficiency. Arab Journal of Gastroenterology. 2017;18(3):165-168. doi:10.1016/j.ajg.2017.09.004
- Ma Q, Kim E-Y, Lindsay EA, Han O. Bioactive Dietary Polyphenols Inhibit Heme Iron Absorption in a Dose-Dependent Manner in Human Intestinal Caco-2 Cells. Journal of Food Science. 2011;76(5):H143-H150. doi:10.1111/j.1750-3841.2011.02184.x
- Delimont NM, Haub MD, Lindshield BL. The Impact of Tannin Consumption on Iron Bioavailability and Status: A Narrative Review. Curr Dev Nutr. 2017;1(2):1-12. doi:10.3945/cdn.116.000042
- Shah YM, Matsubara T, Ito S, Yim S-H, Gonzalez FJ. Intestinal hypoxia-inducible transcription factors are essential for iron absorption following iron deficiency. Cell Metab. 2009;9(2):152-164. doi:10.1016/j.cmet.2008.12.012
- Muckenthaler MU, Galy B, Hentze MW. Systemic iron homeostasis and the iron-responsive element/iron-regulatory protein (IRE/IRP) regulatory network. Annu Rev Nutr. 2008;28:197-213. doi:10.1146/annurev.nutr.28.061807.155521
- Mastrogiannaki M, Matak P, Keith B, Simon MC, Vaulont S, Peyssonnaux C. HIF-2alpha, but not HIF-1alpha, promotes iron absorption in mice. J Clin Invest. 2009;119(5):1159-1166. doi:10.1172/JCI38499
- Nemeth E, Rivera S, Gabayan V, et al. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin. J Clin Invest. 2004;113(9):1271-1276. doi:10.1172/JCI20945
- Lin L, Valore EV, Nemeth E, Goodnough JB, Gabayan V, Ganz T. Iron transferrin regulates hepcidin synthesis in primary hepatocyte culture through hemojuvelin and BMP2/4. Blood. 2007;110(6):2182-2189. doi:10.1182/blood-2007-04-087593
- Moretti D, Goede JS, Zeder C, et al. Oral iron supplements increase hepcidin and decrease iron absorption from daily or twice-daily doses in iron-depleted young women. Blood. 2015;126(17):1981-1989. doi:10.1182/blood-2015-05-642223
- Deschemin J-C, Noordine M-L, Remot A, et al. The microbiota shifts the iron sensing of intestinal cells. FASEB J. 2016;30(1):252-261. doi:10.1096/fj.15-276840
- Bastide, N.; Morois, S.; Cadeau, C.; Kangas, S.; Serafini, M.; Gusto, G.; Dossus, L.; Pierre, F. H.; Clavel-Chapelon, F.; Boutron-Ruault, M.-C. Heme Iron Intake, Dietary Antioxidant Capacity, and Risk of Colorectal Adenomas in a Large Cohort Study of French Women. Cancer Epidemiol. Biomark. Prev. Publ. Am. Assoc. Cancer Res. Cosponsored Am. Soc. Prev. Oncol. 2016, 25 (4), 640–647. https://doi.org/10.1158/1055-9965.EPI-15-0724.
Publications similaires :
- Oméga 3 : quel complément alimentaire choisir ?
- Faut-il éviter le gluten ? Les protéines de lait ? Quels sont les rôles de l’écosystème intestinal sur la santé ?
- Lait premier et deuxième âge : quel lait maternisé choisir pour votre bébé ?
- Équilibre acido-basique : Quel complément alimentaire choisir ?



1 Commentaire